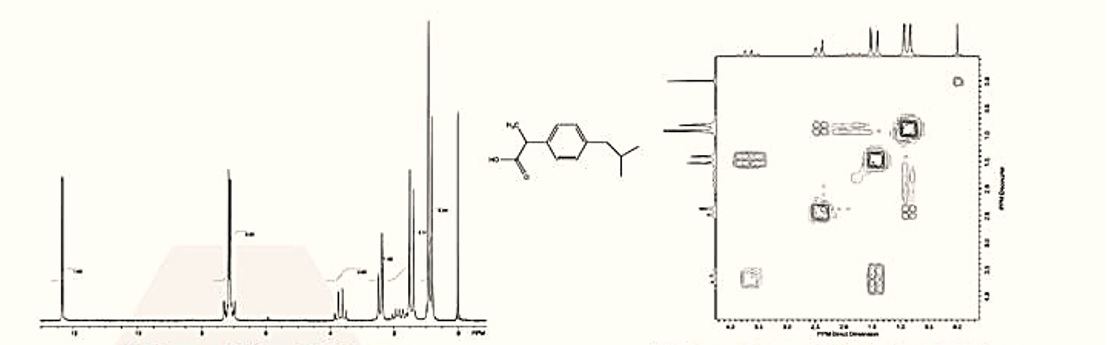
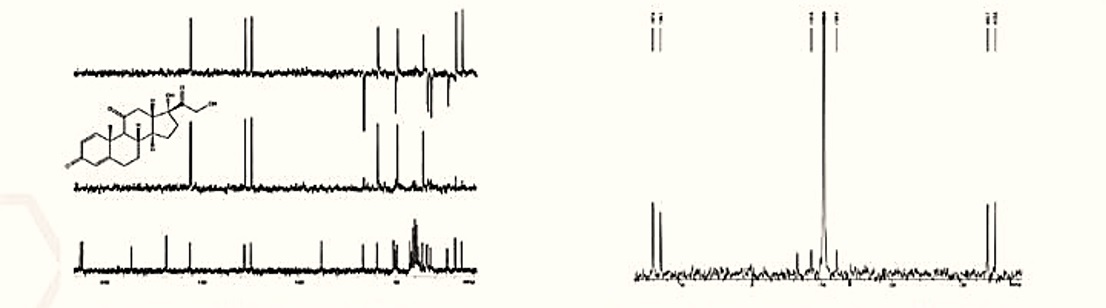
(1) Pokorski, J. K. et al. J Am Chem Soc 2011, 133, 9242.
(2) Renck, D. et al. J Med Chem 2013, 56, 8892.
(3) Majewski, M. W. et al. Tetrahedron Lett 2009, 50, 5175.
(4) Ramasamy, K. et al. Chem Mater 2015, 27, 4640.
(5) Deprele, S. et al. Org Lett 2004, 6, 3805.
(6) McMillen, D. W. et al. J Org Chem 2000, 65, 2532.
(7) Breda, A. et al. Eur J Med Chem 2012, 54, 113.
(8) Ccana-Ccapatinta, G. V. et al. J Nat Prod 2014, 77, 2321.
(9) Rotta, M. et al. Eur J Med Chem 2015, 90, 436.
(10) Knachel, H. C. et al. Ind Eng Chem Res 2012, 51, 10525.
(11) Zhang, T. et al. J Mex Chem Soc 2020, 64(1).
(12) Carrillo-Castillo, T. D. et al. e-Polymers 2020, 20, 624-635.
(13) Martínez-Herrera, R. E. et al. Int J Biol Macromol 2020, 164, 771-782.
(14) Xu, M. et al. J Environ Chem Eng 2020, 8, 104277.
(15) Carrillo-Castillo, T. D. et al. e-Polymers 2021, 21,910-920.
(16) Gutiérrez-López, A. N. et al. J Clean Prod 2022, 372, 133739.
(17) Mascarenhas, N. O. et al. Biomass Convers Bior 2022, 14, 9455-9472.
(18) McClure, M. et al. J U Chem Res 2023, 22(1), 11.
(19) Guo, P. et al. Acs Omega 2023, 8, 49406-49419.
(20) Cai, H. et al. Chem Eng J 2024, 492, 152175.
(21) Singh, M. K. et al. J Drug Deliv Sci Tec 2024, 97, 105792.